図1
1.
はじめに
4月19日にアスベストと悪性中皮腫についてのビデオを観た。クボタという会社が出したアスベスト被害の現状について学んだ。アスベストは耐久性、耐熱性、耐薬品性、電気絶縁性などの特性に非常に優れ安価であるため幅広い分野で使用されていた。しかしアスベスト暴露により悪性中皮腫が引き起こされる。クボタではコンクリート性の水道管を作る際、強度を増すためにアスベストを混ぜて使用していたようだ。アスベストを使用した従業員だけでなく、工場周辺の住民にまで健康被害が及んでいたことは驚きだった。日本ではアスベストよる悪性中皮腫での死亡者数は3000にも及ぶそうだ。私は悪性中皮腫が引き起こされるメカニズムについて興味を持ったのでこの論文を選んだ。
2.
選んだキーワード
Asbestos exposure prevention
論文のタイトル
TNF−α inhibits
asbestos-induced cytotoxicity via a NF-κB-dependent pathway, a possible mechanism for
asbestos-induced oncogenesis
「TNF−αはNF−κBに依存した経路で、アスベストが誘発する細胞障害性を阻害し、それはアスベストが引き起こす腫瘍のメカニズムであると考えられている。」
3.
選んだ論文の内容の概略
アスベストは、悪性中皮腫の主な原因である。多数の研究は、アスベスト照射線量の増加が悪性中皮腫の危険性を増加させることを証明した。アスベストは2つの主なグループに分けられ、そのうちクロシドライトが悪性中皮腫(以下MM)の原因となるアスベストで最も発癌性があると考えられている。アスベストが悪性を誘発するメカニズムは明白ではない。生体内で、大食細胞はアスベストを食菌し、未知のメカニズムによって発癌の一因となるTNF-αと他のサイトカインを放出する。試験管内で、クロシドライトや他のアスベストは始原ヒト中皮細胞(以下HM)の転換を誘導しない。アスベストはHMに非常に細胞障害性である。HMはクロシドライトに遭遇すると、それを貪食しようとするが、その結果HMは広範囲な細胞死を引き起こす。
この発見は、明かに逆説を生んだ。アスベスト暴露したHMが死ぬならば、どのようにアスベストはMMを引き起こすことがありえるのだろうか?アスベストが直接HMの悪性転換を誘発しないので、発癌の間接的なメカニズムはよく研究されていた。そして、アスベスト暴露後に、単核の食細胞の大きな構成要素である炎症反応に発癌の間接的なメカニズムが発見されたのである。大食細胞への分化と同時にこれらの細胞はアスベストを食菌し、多数のサイトカインと酵素を放出する。これらのサイトカインの中で、TNF−αはアスベスト病因との関係があった。しかしこの影響の基礎をなしているメカニズムは不明である。石綿症の動物モデルにおいて、過剰なTNF−αは繊維症の進行と関係することが示された。そして、TNF−αレセプターノックアウトマウスはアスベスト暴露後、繊維増殖的な障害を受けなかった。さらにTNF−αが腫瘍促進と細胞変化の重要な介在者であるという納得のいく証拠が異なる実験的なモデルで存在する。慢性炎症と特定の癌の関連の存在は現在確立されている。そして、TNF−αがいろいろな実験モデルの重要なエフェクターであると最近分かった。同時にこの情報はTMF−αがアスベスト発癌との関連があるかもしない可能性を上げたのである。ここで、この仮説を調査しアスベストによるヒト中皮細胞発癌の可能なメカニズムを現した。
結果
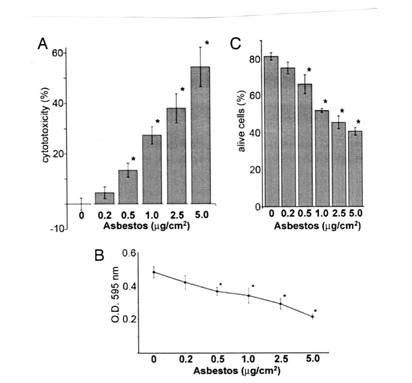
アスベストは、分化においてヒト中皮細胞に細胞障害性である。組織培養のヒト中皮細胞の顕微鏡検査観察は、アスベストが細胞障害性であることを示唆した。これは、乳酸脱水素酵素(LDH)と3-(4,5-dimethylthiazol-2-yl)tetorazolium bromide (MTT)assayを用いて確かめられた。これらの分析評価は、クロシドライトが服用に依存する方法(図1 AとB)でHMに細胞障害性であることを示した。この解釈は、フローサイトメトリー(図1C)によって、さらに確かめられた。例えば、クロシドライト0.5または5.0μg/cm2での暴露後中皮細胞の生存率は24時間で40%から66%で、一週間後には1%であった。この発見は、組織培養において、アスベスト服用に依存する方法で中皮細胞を殺したとき、アスベストがHMの悪性転換を引き起こすことがありえるのかという問題を提起した。
図1
HMを24時間異なった濃度のアスベストに暴露させた。(A)LDHassay 細胞障害性はアスベストによって傷害された細胞から放出されるLDHの量で測定した。暴露量に応じて細胞障害性は高くなった。(B)MTTassay OD量により生存している細胞量を調べた。暴露量が多いほど生存している細胞数は減少した。(C)フローサイトメトリー アネキシンVとプロピディウムインドールに両方陰性のものが生存していると考えた。暴露量の増加は細胞死を高めるとわかった。
アスベストは、TNF-αとTNF-αレセプターTNF-R1の発現を誘導する。悪性中皮腫で遺伝子発現プロフィールを決定するためにRNAマイクロアレイ分析よると、クロシドライトにさらされるHMがTNF-αとTNF-αレセプターmRNAを誘導したと分かった。量的リアルタイムPCR(図2A)を用いてクロシドライトにさらされるHMで、TNF-αmRNAの誘導を確かめた。さらに、クロシドライトにさらされるHMが組織培養(図2B)でTNF-αを産生することが分かった。免疫組織化学は、クロシドライト暴露後、3つの異なる始原中皮細胞培養で各々の大部分のHMがTNF-R1を発現することを示した。ウエスタンブロットによると、TNF-R1が服用に依存する方法(図2C)でアスベスト暴露後、HMで誘発されることを確認した。
図2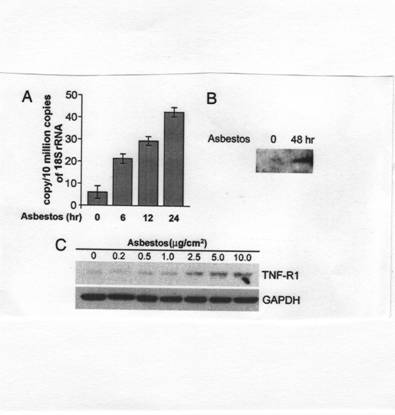
(A)量的リアルタイムPCR HMをアスベスト5μg/cm2にそれぞれ6,12,24時間暴露させた。暴露時間が長いほどTNF-αmRNAの発現が多い。
(B)ウエスタンブロット法 培地のTNF-α量はアスベスト暴露後48時間で大幅に増加した。(C)ウエスタンブロット法 24時間HMを異なる濃度のアスベストに暴露させTNF-R1の発現量を測定した。GAPDHはコントロールである。
TNF-αは、アスベスト細胞毒性を大幅に減少させた。TNF-αがアスベストによって誘発された細胞毒性を調整したという仮説を検証した。HMがTNF-αで前もって処理された時、アスベスト細胞毒性がかなり減少した(図3A)と分かった。0.5μg/ml抗ヒトTNF-α抗血清のHMの組織培養への追加は、TNF-α処置の1時間前に、TNF-αに起因する抗細胞毒性効果を阻害した。マッチされたIgGコントロールは、特性を確認する保護影響を持たなかった。(図3A)これらの結果はフローサイトメトリーによって確かめられた。そして、HM生存能力をアネキシンVとプロピディウムヨウ化物染色で測定した。生存可能な二重陰性の細胞の割合は、HMでかなり高く、そのHMはアスベストとTNF−αに暴露されたものとアスベストにだけ暴露したものとで比較された。MTT分析は、TNF-αがHMをクロシドライト細胞毒性から保護することを確認した。(図3B)
図3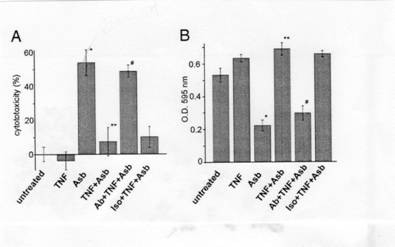
(A)LDH細胞障害性分析 (B)MTT分析
TNF-αは、中でNF-κBの活性化を誘導した。TNF-αには特定の細胞タイプでプログラムされた細胞死を誘発する可能性があるけれども、通常、細胞はNF-κB経路の有力な活性化のためにTNF-αへの暴露から生き残る。図3で観察された保護効果は、TNF-αがHMでNF-κBを誘発可能であったことを示唆した。したがって、TNF-αが核にNF-κBサブユニットp65(RelA)転座を誘発するかどうか調べた。そして、効果がNF-κB活性化と細胞生き残りにあることが分かった。ウエスタンブロット法により、NF-κB p65の量がTNF-α暴露の前ではHMの核でほんのわずかな量だったのが、(図4A、1)TNF-αで処置後、著しく増加することが明らかになった(図4A、2から 6)。EMSAはTNF-αがNF-κB(図4B)のDNA結合活性を誘発することを明らかにした。
図4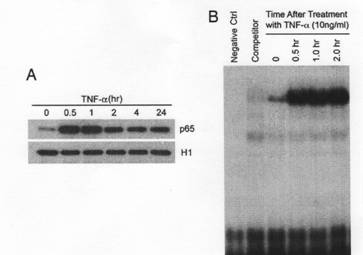
(A)ウエスタンブロット法 H1はコントロール(B)EMSA
TNF-αは、NF-κBシグナリングを通してアスベストによって誘発された細胞毒性を妨げる。NF-κBがTNF-αの抗細胞障害性効果に直接関連があったかどうか調べるために、NF-κB抑制剤Bay11-7082を用いた。この分子はIκBリン酸化抑制剤であり、IκBの安定化を増やしNF-κB核移動と活性化を阻害する。TNF-α(10ng/ml)への暴露が続く一時間、5μM Bay11-7082の有無にかかわらず、HMを30分前もって処理した。LDH分析法は、Bay11-7082によるNF-κB経路の抑制が中皮細胞でTNF-αによって誘導される抗細胞障害性効果を抑えることを示した(図5)。結果は、抗TNF-α抗血清(図3Aと5)を用いて得られるそれらと類似していた。これらの調査結果は、TNF-αがNF-κBシグナリングの活性化を通してHMのアスベストによって誘発された細胞死を防ぐことを示唆した。NF-κB経路が抑制される時でも、Bay11-7082とTNF-αの追加は、この経路がHMでTNF-αによって誘導されないことを確認して、細胞死を誘発しなかった。
図5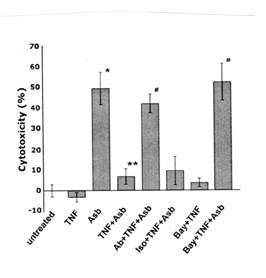
細胞遺伝学的分析。検査された2つの始原ヒト中皮細胞培養は、非常に似た結果をもたらした。コントロールしていないHMの中期は、構造異常を示さなかった。クロシドライトで処理したHMは珍しい中期を示し、未熟な染色体と、動原体でもはやつながれていないかのような染色体の早まった分離が見られた。(図7A)対照的に、アスベスト暴露前にTNF-αで前もって処理されたHMは多数の中期を持ち、それらのほとんどは有糸分裂不規則性なしで、正常な染色体形態を示した(図7B)。要約すると、細胞遺伝学は図1と3の中で報告される実験と一致していた。そして、アスベストが細胞障害性であり、TNF-αによるHMの前処理がアスベストにさらされるHMの生き残りを強化したことを示した。
図7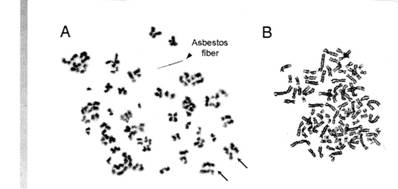
(A)
矢印で示したものが未熟な分裂を示している。(B)TNF-αで前処理したHM
結果と考察
実験により、クロシドライトがHMにTNF-αの分泌とTNF-αレセプターIの発現を誘発するとわかった。TNF-αによるHMの処理は、アスベスト細胞毒性をかなり減らした。この保護影響はTNF−αによって媒介されるNF−κB活性に起因していた。化学抑制体と小さな干渉RNA戦略を含む多数の技術的なアプローチを通して、HMにおいて、TNF-αがNF-κBを活性化させ、そして、NF-κB活性化がHMの生き残りとアスベストの細胞障害性に対する抵抗につながることを証明した。NF-κBに依存的なメカニズムによってシグナルしているTNF-αはクロシドライト暴露を生き残るHMの割合を増やした。実際、Bay11-7082(IκBのリン酸化を妨げる化学合成物)によるNF-κBの抑制は、クロシドライト細胞毒性の上でTNF-αの保護影響を抑えた。TNF-αの存在下で、クロシドライト暴露のため、遺伝子の損害を蓄えたHMは死ぬよりはむしろ、分裂しやすく、これにより悪性中皮腫に至る可能性がある。
大食細胞はTNF−αの主な製作者と考えられる。動物モデルにおいて、アスベストはHMによって単球化学遊走物質タンパク質-1の発現を誘導する。単球化学遊走物質タンパク質-1の発現は、大食細胞刺激的な反応を支持する。大食細胞はアスベストを取り込んだ後、アスベストによって損害を受けるので、TNF-αと他のサイトカインを放出するのである。クロシドライトによって刺激されるとき、TNF-αは中皮細胞によって産生されることもできる。TNF-αは、炎症誘発性サイトカインとNF-κBの主な誘因である。異なる細胞タイプにおいて、TNF-αはどちらの細胞死でも誘発することができるか、よりしばしば、NF-κB活性化を通して、細胞生き残りを増やすことができる。NF-κBの活性化は細胞増殖を促進し、アポトーシスを妨げる。そして、癌の進行を支持する。多数の研究は、大腸と他のタイプの癌で、そして、動物で非ステロイド性抗炎症薬の保護作用を示した。
現在の仮説は慢性炎症がNF-κBの活性化につながるということである。そして、それは順番にprosurvivalな遺伝子の活性化と損害を受けた細胞のアポトーシスの防止に至る。我々の結果は、悪性中皮腫(例えばアスベスト労働者と遺伝的に傾向を与えられた家族)の危険性が高い一団で非ステロイド性抗炎症薬で可能な、効果的防止作用を試験する正当性があるかもしれないことを示す。そのうえ、TNF-αを妨げることは、悪性中皮腫に対する新しい防止的な戦略に至るかもしれない。例えば、Onconase(NF-κB経路を妨げる、そして、一部の悪性中皮腫患者で良好な結果をすでに示した薬)でたとえばエタナーセプト(Enbrel)(NF-κB経路の乳がん患者または混乱で調査中であるTNF-αのための組み換え型おとりレセプター)でTNF-αを妨げることを含むかもしれない。
4.
考察
この論文はアスベストによる悪性中皮腫の発症には、体内で炎症を引き起こす反応経路が主要な役割を果たしていることをつきとめた論文である。細胞は通常ひどく傷つくと死ぬ仕組みを備えている。しかし、炎症状態ではアスベストによって傷ついた異常な細胞が死なずに増殖するという。実験では、人間から採取した中皮細胞にアスベストを加えると、その量に比例して死ぬ細胞が増えるが、炎症にかかわる体内物質のTNF―αも加えると死ななかった。これは「抗炎症剤によって、悪性中皮腫を防げる」ことへの期待につながる。調べてみると、この論文が発表されたことが日本でも話題になっていたようだ。私は、この論文は非常に画期的であると思った。現在の悪性中皮腫の治療は、外科治療、放射線治療、化学療法(抗がん剤治療)および対処療法しかない。抗がん剤の中では2004年に米国FDAでも認可されたぺメドレキセド(アムリタ)のみが他剤(シスプラチン)との併用で生存期間の延長が確認されている。日本でもアムリタは認証され、シスプラチンとの併用で治療が進行中である。しかし、確立された治療法は少ないため、放射線治療や種種の抗がん剤おび外科療法のいずれか、あるいはこれらを組み合わせた治療法しかないからである。抗炎症剤で悪性中皮腫が防げるのなら、抗癌剤よりも患者の体に負担をかけずに治療が行えるのではないかと考えた。
5.
まとめ
アスベストは耐熱性があり安価であることから幅広い分野で用いられた。しかし悪性中皮腫を引き起こすなど、その健康への被害から日本では1975年に吹き付けアスベストの使用禁止、2004年までにアスベストを1%以上含む製品の出荷禁止や大気汚染防止法、廃棄物処理法などでアスベストの管理は定められた。アスベストは暴露後30年から40年して健康被害が出るため、今後も患者数は増えると考えられる。また、調べてみると近年アスベストを含んだ建築物の解体が進んでいるので、アスベストの排出量が2020年から2040年にかけてピークを迎えると予測され、年間10万トン前後のアスベストが排出されると予測されていると分かった。したがってアスベスト使用が禁止される以前に暴露した人に加え、建築物解体に当たる作業員、建築物周辺の住民への健康被害が懸念される。この論文で分かった抗炎症剤により悪性中皮腫が予防できるなら患者数の大幅な減少が期待できると考えられる。